Глава 4. Структура
4.1. первинна структура
Являє собою лінійну ланцюг амінокислот, розташованих в певній послідовності і з'єднаних між собою пептидними зв'язками. Пептидний зв'язок утворюється за рахунок 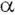 -карбоксільной групи однієї амінокислоти і
-карбоксільной групи однієї амінокислоти і 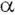 -амін групи інший:
-амін групи інший:
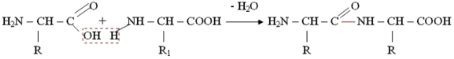
Пептидний зв'язок внаслідок p, 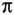 -сопряженія
-сопряженія 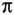 -зв'язку карбонільної групи і р-орбіталі атома N, на якому знаходиться не поділена пара електронів, не може розглядатися як одинарна і обертання навколо неї практично відсутня. З цієї ж причини хіральний атом
-зв'язку карбонільної групи і р-орбіталі атома N, на якому знаходиться не поділена пара електронів, не може розглядатися як одинарна і обертання навколо неї практично відсутня. З цієї ж причини хіральний атом 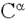 і карбонільний атом
і карбонільний атом 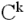 будь-якого i-го амінокислотного залишку пептидного ланцюга і атоми N і
будь-якого i-го амінокислотного залишку пептидного ланцюга і атоми N і 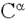 (I + 1) -го залишку знаходяться в одній площині. У цій же площині знаходяться карбонільний атом О і амідний атом Н (проте накопичений при вивченні структури білків матеріал показує, що це твердження не зовсім строго: атоми, пов'язані з пептидним атомом азоту , Знаходяться не в одній площині з ним, а утворюють тригранну піраміду з кутами між зв'язками, дуже близькими до 120 градусів. Тому між площинами, утвореними атомами
(I + 1) -го залишку знаходяться в одній площині. У цій же площині знаходяться карбонільний атом О і амідний атом Н (проте накопичений при вивченні структури білків матеріал показує, що це твердження не зовсім строго: атоми, пов'язані з пептидним атомом азоту , Знаходяться не в одній площині з ним, а утворюють тригранну піраміду з кутами між зв'язками, дуже близькими до 120 градусів. Тому між площинами, утвореними атомами 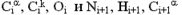 , Існує деякий кут, що відрізняється від 0. Але, як правило, він не перевищує 1 і не грає особливої ролі). Тому геометрично полипептидную ланцюжок можна розглядати як утворену такими плоскими фрагментами, що містять кожен по шість атомів. Взаємне розташування цих фрагментів, як і будь-яке взаємне розташування двох площин, має визначаться двома кутами. Серед таких прийнято брати торсіонні кути, що характеризують обертання навколо
, Існує деякий кут, що відрізняється від 0. Але, як правило, він не перевищує 1 і не грає особливої ролі). Тому геометрично полипептидную ланцюжок можна розглядати як утворену такими плоскими фрагментами, що містять кожен по шість атомів. Взаємне розташування цих фрагментів, як і будь-яке взаємне розташування двох площин, має визначаться двома кутами. Серед таких прийнято брати торсіонні кути, що характеризують обертання навколо 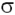 -зв'язків N-
-зв'язків N- 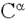 і
і 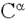 -
- 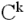 .
.
Геометрія будь молекули визначається трьома групами геометричних характеристик її хімічних зв'язків - довжинами зв'язків, валентними кутами і торсійними кутами між зв'язками, що примикають до сусідніх атомів. Перші дві групи у вирішальній мірі визначаються природою беруть участь атомів і утворюються зв'язків. Тому просторова структура полімерів в основному визначається торсійними кутами між ланками полімерного остова молекул, тобто конформацией полімерного ланцюга. Торсійний кут, тобто кут повороту зв'язку А-В навколо зв'язку В-С щодо зв'язку С-D, визначається як кут між площинами, що містять атоми А, В, С і атоми B, C, D.
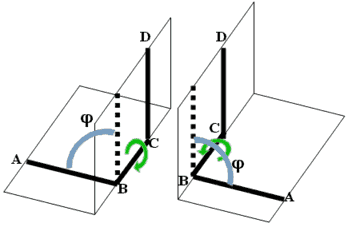
У такій системі можливий випадок, коли зв'язку А-В і С-D розташовані паралельно і перебувають по одну сторону від зв'язку В-С. Якщо розглядати цю систему уздовж зв'язку В-С, то зв'язок А-В як би затуляє зв'язок CD, тому така конформація називається заслоненной. Згідно з рекомендаціями міжнародних союзів хімії IUPAC (International Union of Pure and Applied Chemistry) і IUB (International Union of Biochemistry), кут між площинами ABC і BCD вважається позитивним, якщо для приведення конформації в заслоненного стан шляхом повороту на кут не вище 180 ближню до спостерігача зв'язок потрібно повертати за годинниковою стрілкою. Якщо цей зв'язок для отримання закритої конформації потрібно повертати проти годинникової стрілки, то кут вважається негативним. Можна помітити, що це визначення не залежить від того, яка з зв'язків знаходиться ближче до спостерігача.
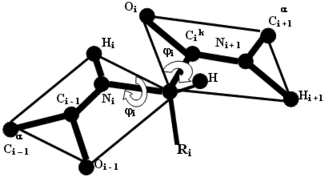
При цьому, як видно з малюнка, орієнтація фрагмента, що містить атоми ![При цьому, як видно з малюнка, орієнтація фрагмента, що містить атоми i + 1 і i [(i-1) -й фрагмент], і фрагмента, що містить атоми i і i + 1 (i-й фрагмент), визначається торсійними кутами, відповідними обертанню навколо зв'язку N i- i і зв'язку i - i](/wp-content/uploads/2020/01/uk-glava-41-pervinna-struktura-struktura-bilok-i-vse-pro-nogo-v-biologii-i-himii-6.gif) i + 1 і
i + 1 і 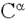 i [(i-1) -й фрагмент], і фрагмента, що містить атоми
i [(i-1) -й фрагмент], і фрагмента, що містить атоми 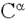 i і
i і 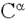 i + 1 (i-й фрагмент), визначається торсійними кутами, відповідними обертанню навколо зв'язку N i-
i + 1 (i-й фрагмент), визначається торсійними кутами, відповідними обертанню навколо зв'язку N i- 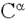 i і зв'язку
i і зв'язку 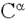 i -
i - 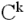 i. Ці кути прийнято позначати як
i. Ці кути прийнято позначати як 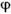 і
і 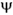 , В наведеному випадку відповідно
, В наведеному випадку відповідно 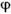 i і
i і 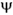 i. Їх значеннями для всіх мономерних ланок поліпептидного ланцюга в основному визначається геометрія цьому ланцюзі. Ніяких однозначних величин ні для значення кожного з цих кутів, ні для їх комбінацій не існує, хоча на ті і на інші накладаються обмеження, які визначаються як властивостями самих пептидних фрагментів, так і природою бічних радикалів, тобто природою амінокислотних залишків.
i. Їх значеннями для всіх мономерних ланок поліпептидного ланцюга в основному визначається геометрія цьому ланцюзі. Ніяких однозначних величин ні для значення кожного з цих кутів, ні для їх комбінацій не існує, хоча на ті і на інші накладаються обмеження, які визначаються як властивостями самих пептидних фрагментів, так і природою бічних радикалів, тобто природою амінокислотних залишків.
До теперішнього часу встановлено послідовності амінокислот для декількох тисяч різних білків. Запис структури білків у вигляді розгорнутих структурних формул громіздка і не наочна. Тому використовується скорочена форма запису - трибуквених або однобуквеним (молекула вазопресину):

При записи амінокислотною послідовності в поліпептидних або олігопептідних ланцюгах за допомогою скороченою символіки передбачається, якщо це не обумовлено, що 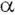 -аминогруппами знаходиться зліва, а
-аминогруппами знаходиться зліва, а 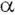 -карбоксільная група - справа. Відповідні ділянки поліпептидного ланцюга називають N-кінцем (аміни кінцем) і С-кінцем (карбоксильних кінцем), а амінокислотні залишки - відповідно N-кінцевим і С-кінцевим залишками.
-карбоксільная група - справа. Відповідні ділянки поліпептидного ланцюга називають N-кінцем (аміни кінцем) і С-кінцем (карбоксильних кінцем), а амінокислотні залишки - відповідно N-кінцевим і С-кінцевим залишками.
