§7.4 Вода. Водневий зв'язок.
Жодна з планет Сонячної системи не містить на своїй поверхні такої великої кількості води, як наша Земля. Моря і океани, середня глибина яких близько 6 км, покривають 71% поверхні Землі. Величезна кількість води у вигляді снігу і льоду зосереджено в приполярних районах.
Цей дивовижний факт поки не знайшов однозначного пояснення. Безумовно, вода відіграє величезну роль у виникненні та існуванні життя на нашій планеті. Багато в чому це пов'язано з властивостями, яких немає у її найближчих сусідів і аналогів (H2S, H2Se і т.д. - див. Таблицю 7-1 в попередньому параграфі). Перш за все потрібно розібратися, чому вода може перебувати в рідкому і навіть в твердому стані (лід) в умовах, в яких схожі сполуки водню з більш важкими елементами (сіркою, селеном і т.д.) газоподібні.
Молекула води має наступну будову:
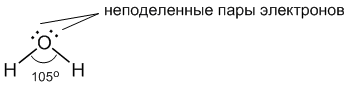
Дві поділені електронні пари беруть участь в утворенні двох полярних ковалентних зв'язків, а що залишилися дві неподіленого пари електронів теж відіграють важливу роль у властивостях води. Всі заступники у атома кисню, включаючи неподіленого пари, прагнуть розташуватися якомога далі один від одного (згадайте §3.6). Це призводить до того, що молекула набуває форму спотвореного тетраедра з атомом кисню в центрі. У чотирьох вершинах цього "тетраедра" знаходяться два атома водню і дві неподіленого пари електронів. Але якщо дивитися тільки по центрам атомів, то виходить, що молекула води має кутову будову, причому кут Н-О-Н становить приблизно 105 градусів.
Для виникнення водневих зв'язків важливо, щоб в молекулах речовини були атоми водню, пов'язані з невеликими, але електронегативними атомами, наприклад: O, N, F. Це створює помітний частковий позитивний заряд на атомах водню. З іншого боку, важливо, щоб у електронегативний атомів були неподіленого електронні пари. Коли збіднений електронами атом водню однієї молекули (акцептор) взаємодіє з неподіленої електронної парою на атомі N, O або F іншої молекули (донор), то виникає зв'язок, схожа на полярну ковалентну.
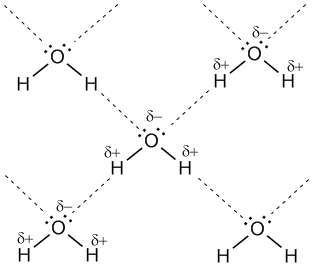
Мал. 7-1а. Водневі зв'язки між молекулами води (позначені пунктиром).
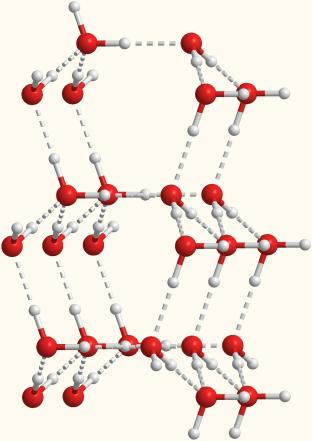
Мал. 7-1б. Об'ємна модель, що показує розташування молекул води, пов'язаних водневими зв'язками.
З огляду на помітну різницю зарядів на атомах Н і О сусідніх молекул, додаткову міцність цієї міжмолекулярної зв'язку надає тяжіння різнойменних зарядів. Водневі зв'язки характерні для таких речовин, як вода H2O, аміак NH3, фтороводород HF.
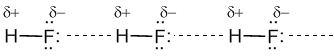
 У водних розчинах аміаку або HF ці молекули утворюють водневі зв'язки не тільки між собою, а й з молекулами води. Завдяки водневим зв'язкам аміак NH3 має фантастичну розчинність: в 1 л води може розчинятися 750 л газоподібного аміаку! В органічних речовинах зустрічаються також внутрішньо-молекулярні водневі зв'язку, сильно впливають на просторову форму цих молекул.
У водних розчинах аміаку або HF ці молекули утворюють водневі зв'язки не тільки між собою, а й з молекулами води. Завдяки водневим зв'язкам аміак NH3 має фантастичну розчинність: в 1 л води може розчинятися 750 л газоподібного аміаку! В органічних речовинах зустрічаються також внутрішньо-молекулярні водневі зв'язку, сильно впливають на просторову форму цих молекул.
Енергія зв'язку водневого зв'язку Н --- О в димере води (H2O) 2 становить 21,5 кДж / моль, а її довжина 2,04 А. Таким чином, ці зв'язки довші і приблизно в 10-20 разів менше міцні, ніж звичайні ковалентні, але саме вони змушують воду бути рідиною або льодом (а не газом) в звичайних умовах. Водневі зв'язки руйнуються тільки тоді, коли рідка вода переходить в пар.
При температурах вище 0 ° С (але нижче температури кипіння) вода вже не має таку впорядковану міжмолекулярної структуру, як показано на малюнках 7-1а і 7-1б. Тому в рідкій воді молекули пов'язані між собою лише в окремі агрегати з декількох молекул. Ці агрегати можуть вільно рухатися поруч один з одним, утворюючи рухливу рідина. Але при зниженні температури впорядкованість стає все більше і більше, а агрегати - все більшими. Нарешті, утворюється лід, який має приблизно таку впорядковану структуру, як на рис. 7-1б і 3-15 з §3.8.
До речі, на цих малюнках добре видно, що в кристалі льоду між молекулами залишаються порожнечі. Обсяг пустот трохи більше, ніж розмір окремої молекули Н2О. Тому лід має меншу щільність, ніж рідка вода і плаває на поверхні. Більшість же інших речовин при замерзанні збільшує свою щільність.
Таким чином, водневі зв'язку надають воді ще одна унікальна властивість, без якого навряд чи могла б існувати різноманітна життя в тих районах Землі, де температура взимку знижується нижче 0 ° С. Якби лід тонув у воді, то взимку все водойми промерзали б до самого дна. Важко очікувати, що риби погодилися б жити в таких умовах. Людина могла б розтоплювати лід, перетворюючи його в воду для своїх потреб, але це вимагало б величезних витрат додаткової енергії.

** Ще одне красиве прояв водневих зв'язків
- блакитний колір чистої води в її товщі. Коли одна молекула води коливається, вона змушує коливатися і пов'язані з нею водневими зв'язками інші молекули. На порушення цих коливань витрачаються червоні промені сонячного спектра, як найбільш підходящі по енергії. Таким чином, з сонячного спектра "фільтруються" червоні промені - їх енергія поглинається і розсіюється хитаються молекулами води у вигляді тепла.
У білому сонячному світлі різні кольори як би врівноважують один одного. Тому сонячне світло здається оку "білим"
